Como eu faço?
Otimização da dose de biológicos
Por: Fábio Vieira Ferreira
Mestre e Doutor em Cirurgia pela UNESP Botucatu/Mayo Clinic Scottsdale, EUA
Membro Especialista e Titular da SBCP e do GEDIIB
Diretor Médico da Clínica GastroSaúde, Marília - SP
Hoje vivemos uma nova era no tratamento das doenças inflamatórias intestinais (DII). A chegada dos biológicos foi um marco no manejo da DII que teve como consequência a mudança da história natural dessas doenças com a consequente redução no número de hospitalizações, cirurgias e manutenção da remissão clínica por um longo prazo 1,2. Passamos da uma era “pré-histórica” do início dos biológicos – etapa de aprendizagem no manejo desses fármacos entre 1999 a 2010 - onde se conhecia muito pouco sobre imunogenicidade, o erro do uso episódico ao invés de doses programadas, o desconhecimento de janela de oportunidade terapêutica, além do desconhecimento sobre otimização de tratamento 3,4,5,6. Hoje, nós médicos especialistas, mais experientes no manejo dessas drogas, podemos dizer que vivemos um momento ainda mais promissor. Isso é refletido em números. Recentemente, um estudo americano que 250.000 pacientes com DII tratados com biológicos nos últimos 5 anos (2015 a 2020) reportou que as taxas de cirurgias relacionadas a DII reduziu significativamente mais comparada a períodos anteriores. Pessoalmente, eu chamo esse primeiro período inicial que começamos a manejar um medicamento esses anticorpos monoclonais, de era pré-histórica dos biológicos. Eu uso essa expressão peculiar pois acredito que muito se apreendeu nessas últimas das décadas, desde a aprovação do infliximabe no tratamento da doença de Crohn 2.
A perda da resposta a um agente anti-TNF começou ser mais bem estudada após a análise de estudos realizados em centro de referência que demostraram que após um ano de uso do infliximabe, cerca de 20% dos doentes, por algum motivo, perdiam a resposta do tratamento (perda de resposta secundária) 8. Cada vez mais esse achado se tornou evidente e hoje sabemos que todos os medicamentos biológicos, uns mais, outros menos, perdem resposta ao longo do tratamento 9. Todavia, na era “pré-histórica” não sabíamos que a otimização da terapia, ou seja, aumento da dose do biológico e mesmo a redução do intervalo entre uma infusão ou uma injeção era uma medida efetiva e seguro na recuperação da resposta terapêutica que havia sido perdida ao longo do tempo.
Hoje, é consenso entre todos os especialistas no manejo da DII que antes de pensar em substituir um medicamento, devemos primeiro otimizar a terapia atual quando identificamos uma perda de resposta secundária 8,9,19,11,12. Entretanto, a monitorização terapêutica de drogas, conhecida pela sigla TDM (Therapeutic Drug Monitoring) nos facilitou para identificar quando o aumento da dose do biológico será eficaz na recuperação da resposta. Nos pacientes que a perda de resposta esteja associada a produção de anticorpos contra droga ou naqueles que mesmo com nível terapêutico adequado ainda manifestem atividade inflamatória, a mudança de medicamento se faz necessária. Entretanto, em mais de 50% dos casos de perda de resposta, a causa principal é a redução no nível sérico da droga. Ou seja, aumentando a dose recuperaremos a resposta terapêutica em mais de 50% dos casos 13, 14, 15, 16, 17, 18, 19.
Como eu faço na minha prática clínica
Sou coloproctologista e tenho experiência no tratamento da doença infamatória intestinal faz mais de 20 anos. Eu passei pelas fases de aprendizagem no manejo de imunobiológicos. Não restam dúvidas que a identificação de fatores de risco com início precoce do tratamento (janela de oportunidade), a monitorização rigorosa da resposta e da remissão clínica ao longo do tempo (tight control) são fatores cruciais na mudança da história natural dessas doenças.
Na minha prática clínica, é sugerido que os pacientes retornem para consultas programadas a da 3 ou 4 meses para serem avaliados clinicamente e por meio de marcadores inflamatórios como proteína C reativa (PCR) e calprotectina fecal. Hoje está bem documentado na literatura mundial que a busca de um alvo terapêutico desde o início do tratamento e a manutenção do objetivo previamente programado, é a única forma de mudar a história natural dessas doenças. A isso chamamos de Treat-to-Target (T2T). O alvo a ser atingido e mantido é a cicatrização da mucosa intestinal ou cicatrização endoscópica 20. Inclusive, a estratégia T2T é custo-efetiva para o sistema de saúde 21.
Quando um paciente tem sintomas de perda de resposta (diarreia, muco, sangramento, dor abdominal, anemia, etc.) deve se investigado por meio de exames endoscópicos e de imagem, como por exemplo a enterro TC ou enterro RMN. Ademais, quando identificamos alteração nos marcadores de inflamação, mesmo que o (a) paciente esteja assintomático (a), devemos buscar ativamente uma possível reativação da doença. Com essa atitude reativa podemos identificar precocemente uma perda de resposta e com isso procedermos com a otimização da terapia. Sabemos que o TDM realizado de forma reativa pode nos ajudar a identificar um perda de resposta permitindo que aumentemos a dose nos casos que nível subterapêutico e até troquemos de medicamento.
FIGURA 1 A otimização da terapia dependerá do tipo de medicamento que você escolheu. É possível adicionar um imunossupressor, como por exemplo nos casos dos anti-TNF e podemos aumentar a dose ou reduzir o intervalo das infusões/injeções com a finalidade de aumentar o nível sérico da droga. TABELA 1
FIGURA 1 – Estratégia de tratamento na suspeita de perda de resposta – adaptado referência 22
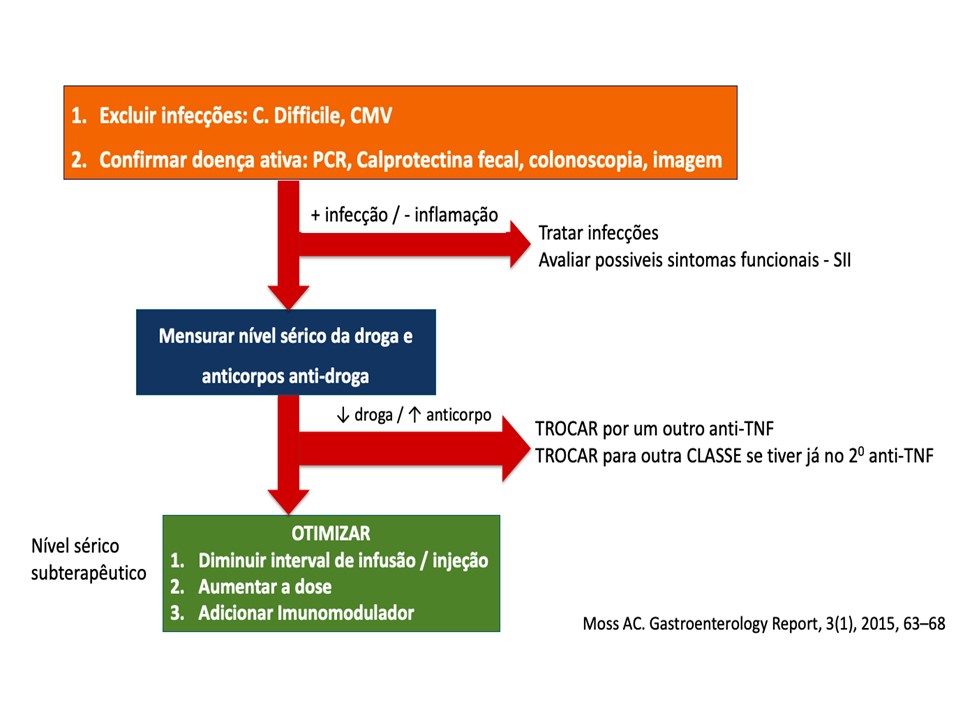
TABELA 1 – Opções otimização terapêutica em pacientes com perda de resposta secundária ao tratamento com biológicos.
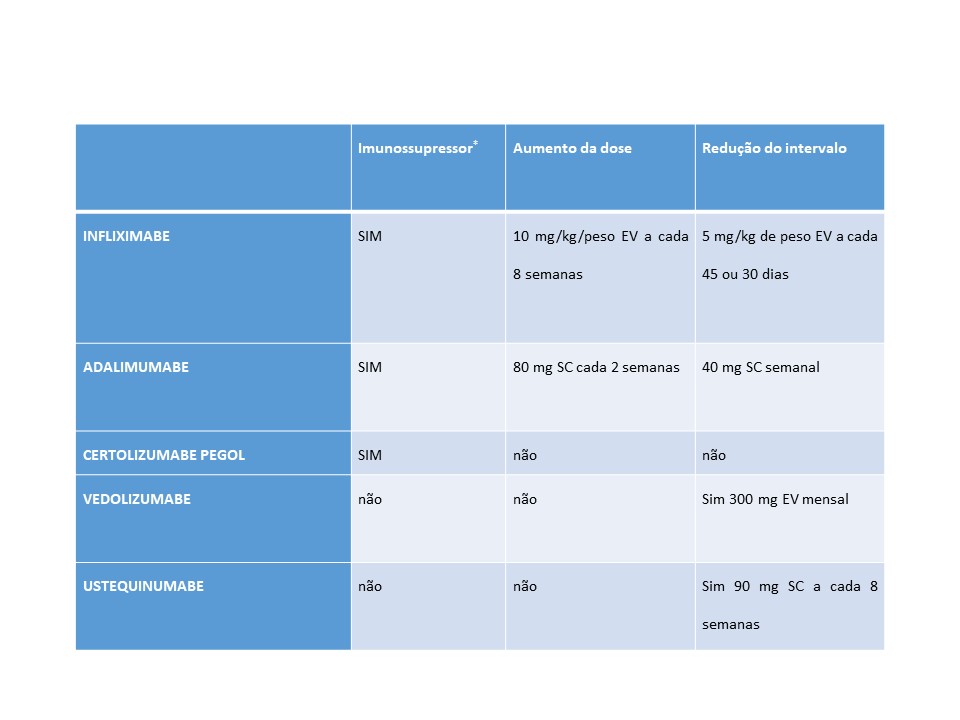
*Imunossupressores disponíveis: azatioprina: 2,0 a 2,5mg/kg de peso/dia, 6 Mercaptopurina 1,5 a 2,5 mg/kg/peso/dia ou metotrexato 10 a 25 mg IM / semana
Até quando devo insistir com a otimização a busca de uma resposta terapêutica?
Essa pergunta realmente é difícil de responder pela escassez na literatura de estudos desenhados especificamente para responder essa questão. Todavia, recentemente o STRIDE II (consenso de especialistas em DII) fez uma sugestão de quanto tempo deveríamos insistir na terapia de otimização à busca de uma resposta.
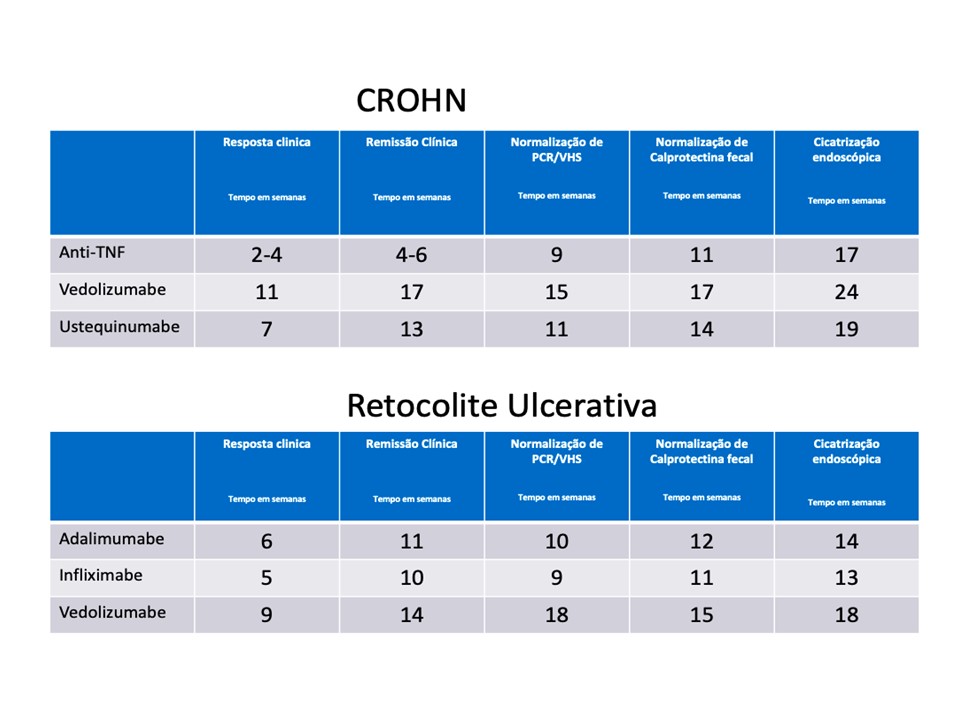
FIGURA 2
FIGURA 2 – Tempo (número médio de semanas) necessário para atingir a meta após o início do tratamento para a doença de Crohn e na Retocolite ulcerativa - Adaptado da referência 20
Referência Bibliográfica
- Kotze PG, Underwood FE, Damião AOMC, Ferraz JGP, Saad-Hossne R, Toro M, Iade B, Bosques-Padilla F, Teixeira FV, Juliao-Banos F, Simian D, Ghosh S, Panaccione R, Ng SC, Kaplan GG. Progression of Inflammatory Bowel Diseases Throughout Latin America and the Caribbean: A Systematic Review. Clin Gastroenterol Hepatol. 2020 Feb;18(2):304-312
- http://conitec.gov.br/images/Protocolos/DoencaCrohn.pdf, acesso 15/04/2021
- Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W, Rutgeerts P; ACCENT I Study Group. Maintenance infliximab for Crohn's disease: the ACCENT I randomised trial. 2002 May 4;359(9317):1541-9. doi: 10.1016/S0140-6736(02)08512-4. PMID: 12047962.
- Rutgeerts P, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W, Hanauer SB. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn's disease. 2004 Feb;126(2):402-13
- Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, Lichtiger S, D'Haens G, Diamond RH, Broussard DL, Tang KL, van der Woude CJ, Rutgeerts P; SONIC Study Group. Infliximab, azathioprine, or combination therapy for Crohn's disease. N Engl J Med. 2010 Apr 15;362(15):1383-95
- Hamdeh S, Aziz M, Altayar O, Olyaee M, Murad MH, Hanauer SB. Early vs Late Use of Anti-TNFa Therapy in Adult Patients With Crohn Disease: A Systematic Review and Meta-Analysis. Inflamm Bowel Dis. 2020 Nov 19;26(12):1808-1818
- Khoudari G, Mansoor E, Click B, Alkhayyat M, Saleh MA, Sinh P, Katz J, Cooper GS, Regueiro M. Rates of Intestinal Resection and Colectomy in Inflammatory Bowel Disease Patients After Initiation of Biologics: A Cohort Study. Clin Gastroenterol Hepatol. 2020 Oct 14:S1542-3565(20)31397-5 . doi: 10.1016/j.cgh.2020.10.008. Epub ahead of print. PMID: 33065311
- Chaparro M, Panes J, García V, Mañosa M, Esteve M, Merino O, Andreu M, Gutierrez A, Gomollón F, Cabriada JL, Montoro MA, Mendoza JL, Nos P, Gisbert JP. Long-term durability of infliximab treatment in Crohn's disease and efficacy of dose "escalation" in patients losing response. J Clin Gastroenterol. 2011 Feb;45(2):113-8
- Qiu Y, Chen BL, Mao R, Zhang SH, He Y, Zeng ZR, Ben-Horin S, Chen MH. Systematic review with meta-analysis: loss of response and requirement of anti-TNFα dose intensification in Crohn's disease. J Gastroenterol. 2017 May;52(5):535-554
- Einarson TR, Bereza BG, Ying Lee X, Lelli F. Dose escalation of biologics in Crohn's disease: critical review of observational studies. Curr Med Res Opin. 2017 Aug;33(8):1433-1449. doi: 10.1080/03007995.2017.1335001. Epub 2017 Jun 11. PMID: 28537467.
- Teixeira FV, Sassaki LY, Saad-Hossne R, Baima JP, Magro DO, Coy CSR, Kotze PG. Serum infliximab measurement in Inflammatory Bowel Diseasepatients in remission: a comparative analysis of two different methods in a multicentric Brazilian cohort. Arq Gastroenterol. 2018 Apr-Jun;55(2):192-197
- Queiroz NSF, Teixeira FV, Parra RS, Kotze PG. Induction therapeutic drug monitoring regimen with infliximab: a simplified evidence-based algorithm for Inflammatory Bowel Disease. Arq Gastroenterol. 2020 Oct-Dec;57(4):507-510
- Vande Casteele N, Herfarth H, Katz J, Falck-Ytter Y, Singh S. American Gastroenterological Association Institute Technical Review on the Role of Therapeutic Drug Monitoring in the Management of Inflammatory Bowel Diseases. 2017 Sep;153(3):835-857.e6.
- Katz L, Gisbert JP, Manoogian B, Lin K, Steenholdt C, Mantzaris GJ, Atreja A, Ron Y, Swaminath A, Shah S, Hart A, Lakatos PL, Ellul P, Israeli E, Svendsen MN, van der Woude CJ, Katsanos KH, Yun L, Tsianos EV, Nathan T, Abreu M, Dotan I, Lashner B, Brynskov J, Terdiman JP, Higgins PD, Chaparro M, Ben-Horin S. Doubling the infliximab dose versus halving the infusion intervals in Crohn's disease patients with loss of response. Inflamm Bowel Dis. 2012 Nov;18(11):2026-33
- Dumitrescu G, Amiot A, Seksik P, Baudry C, Stefanescu C, Gagniere C, Allez M, Cosnes J, Bouhnik Y. The outcome of infliximab dose doubling in 157 patients with ulcerative colitis after loss of response to infliximab. Aliment Pharmacol Ther. 2015 Nov;42(10):1192-9
- Cesarini M, Katsanos K, Papamichael K, et al. Dose optimization is effective in ulcerative colitis patients losing response to infliximab: a collaborative multicentre retrospective study. Dig Liver Dis 2014; 46: 135–9.
- Paul S, Williet N, Nancey S, Veyrard P, Boschetti G, Phelip JM, Flourie B, Roblin X. No Difference of Adalimumab Pharmacokinetics When Dosed at 40 mg Every Week or 80 mg Every Other Week in IBD Patients in Clinical Remission After Adalimumab Dose Intensification. Dig Dis Sci. 2020 Sep 16
- Peyrin-Biroulet L, Danese S, Argollo M, Pouillon L, Peppas S, Gonzalez-Lorenzo M, Lytras T, Bonovas S. Loss of Response to Vedolizumab and Ability of Dose Intensification to Restore Response in Patients With Crohn's Disease or Ulcerative Colitis: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2019 Apr;17(5):838-846.e2
- Restellini S, Khanna R, Afif W. Therapeutic Drug Monitoring With Ustekinumab and Vedolizumab in Inflammatory Bowel Disease. Inflamm Bowel Dis. 2018 Sep 15;24(10):2165-2172. doi: 10.1093/ibd/izy134. PMID: 29788272.
- Turner D, Ricciuto A, Lewis A, D'Amico F, Dhaliwal J, Griffiths AM, Bettenworth D, Sandborn WJ, Sands BE, Reinisch W, Schölmerich J, Bemelman W, Danese S, Mary JY, Rubin D, Colombel JF, Peyrin-Biroulet L, Dotan I, Abreu MT, Dignass A; International Organization for the Study of IBD. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. 2021 Apr;160(5):1570-1583. doi: 10.1053/j.gastro.2020.12.031. Epub 2021 Feb 19. PMID: 33359090
- Panaccione R, Colombel JF, Travis SPL, Bossuyt P, Baert F, Vaňásek T, Danalıoğlu A, Novacek G, Armuzzi A, Reinisch W, Johnson S, Buessing M, Neimark E, Petersson J, Lee WJ, D'Haens GR. Tight control for Crohn's disease with adalimumab-based treatment is cost-effective: an economic assessment of the CALM trial. 2020 Apr;69(4):658-664. doi: 10.1136/gutjnl-2019-318256. Epub 2019 Jul 8. PMID: 31285357; PMCID: PMC7063396.
- Moss AC. Optimizing the use of biological therapy in patients with inflammatory bowel disease. Gastroenterol Rep (Oxf). 2015 Feb;3(1):63-8. doi: 10.1093/gastro/gou087. Epub 2015 Jan 6. PMID: 25567472; PMCID: PMC4324872.
Listagem de textos
- 30/06/2021 - Manuseio do paciente com anismus
- 28/04/2021 - Otimização da dose de biológicos
- 10/09/2020 - Otimização de biológicos nas DIIs
- 02/07/2020 - Tratamento cirúrgico da constipação intestinal
- 14/05/2020 - Endometriose – Novas tendências no tratamento cirúrgico
- 11/09/2019 - Cuidados essenciais na polipectomia difícil
- 25/03/2019 - Indicação de eletromanometria em operações anorretais
- 29/11/2017 - Megacolo Chagásico Atualidades: Diagnóstico preciso é fundamental
- 20/07/2017 - Avaliação funcional do assoalho pélvico
- 03/04/2017 - Tratamento da Doença de Crohn perineal. Como eu faço?
- 13/09/2016 - Manobras para levar a bolsa ileal ao canal anal
- 25/07/2016 - Diagnóstico da Síndrome de Lynch
- 12/05/2016 - Tratamento da RCUI no consultório
- 16/03/2016 - Tratamento Médico da Ileíte Crohn
- 21/10/2015 - Tratamento dos condilomas acuminados perianais
